Внимание! Документ недействующий.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И
СОЦИАЛЬНОГО РАЗВИТИЯ
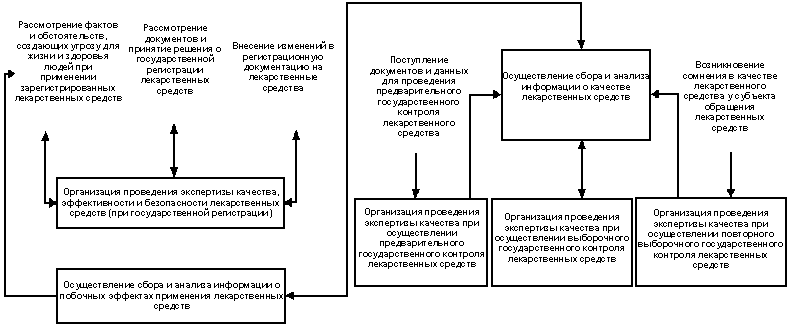
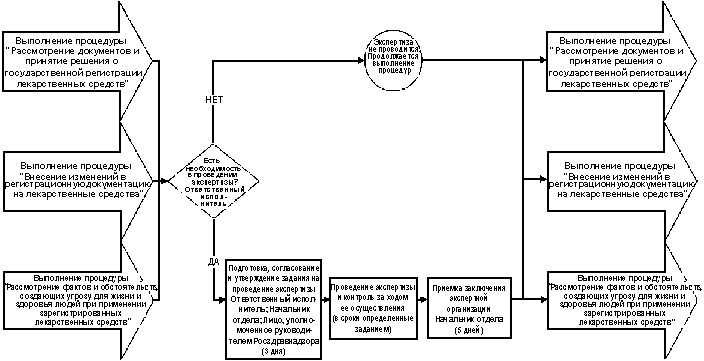
РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРИКАЗ
от 30 октября 2006 года N 734
Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения и социального развития по исполнению государственной функции по организации проведения экспертизы качества, эффективности и безопасности лекарственных средств
Утратил силу с 21 апреля 2015 года на
основании
приказа Минздрава России от 11 марта 2015
года N 91н
В соответствии с постановлением
Правительства Российской Федерации от 11
ноября 2005 года N 679 "О порядке разработки и
утверждения административных
регламентов исполнения государственных
функций и административных регламентов
предоставления государственных услуг"
(Собрание законодательства Российской
Федерации, 2005, N 47, ст.4933) и Положением о
Министерстве здравоохранения и
социального развития Российской
Федерации, утвержденным постановлением
Правительства Российской Федерации от 30
июня 2004 года N 321 "Об утверждении
Положения о Министерстве
здравоохранения и социального развития
Российской Федерации" (Собрание
законодательства Российской Федерации,
2004, N 28, ст.2898; 2005, N 2, ст.162; 2006, N 19, ст.2080),
приказываю:
1.
Утвердить прилагаемый Административный
регламент Федеральной службы по надзору
в сфере здравоохранения и социального
развития по исполнению государственной
функции по организации проведения
экспертизы качества, эффективности и
безопасности лекарственных средств.
2.
Федеральной службе по надзору в сфере
здравоохранения и социального развития
(Р.У.Хабриев) обеспечить проведение
экспертизы качества, эффективности и
безопасности лекарственных средств в
соответствии с Административным
регламентом, утвержденным настоящим
приказом.
3.
Признать утратившими силу приказы
Министерства здравоохранения
Российской Федерации от 4 апреля 2003 года N
137 "Об утверждении Порядка осуществления
государственного контроля качества
лекарственных средств на территории
Российской Федерации" (зарегистрирован
Минюстом России 10 апреля 2003 года,
регистрационный N 4399) и от 28 мая 2003 года N
223 "Об утверждении Положения о порядке
проведения государственного контроля
эффективности и безопасности
лекарственных средств на территории
Российской Федерации" (зарегистрирован
Минюстом России 3 июня 2003 года,
регистрационный N 4633).
4.
Контроль за исполнением настоящего
приказа возложить на заместителя
Министра здравоохранения и социального
развития Российской Федерации
В.И.Стародубова.
Министр
М.Ю.Зурабов
Зарегистрировано
в Министерстве юстиции
Российской Федерации
30 ноября 2006 года,
регистрационный N 8541
Приложение
АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ
Федеральной службы по надзору в сфере
здравоохранения и социального развития
по исполнению государственной функции
по организации проведения экспертизы
качества, эффективности и безопасности
лекарственных средств
I. Общие положения
1.1. Административный
регламент Федеральной службы по надзору
в сфере здравоохранения и социального
развития по исполнению государственной
функции по организации проведения
экспертизы качества, эффективности и
безопасности лекарственных средств
(далее - Регламент) разработан с учетом
требований Федерального закона от 22.06.98 N
86-ФЗ "О лекарственных средствах"
(Собрание законодательства Российской
Федерации, 1998, N 26, ст.3006), в соответствии с
постановлением Правительства
Российской Федерации от 11.11.2005 N 679 "О
порядке разработки и утверждения
административных регламентов
исполнения государственных функций и
административных регламентов
предоставления государственных услуг"
(Собрание законодательства Российской
Федерации, 2005, N 47, ст.4933) и в рамках
полномочий, установленных Положением о
Федеральной службе по надзору в сфере
здравоохранения и социального развития,
утвержденным постановлением
Правительства Российской Федерации от
30.06.2004 N 323 (Собрание законодательства
Российской Федерации, 2004, N 28, ст.2900).
1.2. Организация проведения
экспертизы качества, эффективности и
безопасности лекарственных средств
представляет собой функцию Федеральной
службы по надзору в сфере
здравоохранения и социального развития
по привлечению научных, иных
организаций, ученых и специалистов для
проработки вопросов качества,
эффективности и безопасности
лекарственных средств посредством
проведения исследований, анализа и
оценки объектов экспертизы, подготовки
заключений относительно этих объектов.
При возникновении необходимости в
экспертизе качества, эффективности и
безопасности лекарственных средств в
ходе проведения мероприятий по
государственному контролю в сфере
обращения лекарственных средств ее
организацию осуществляет Федеральная
служба по надзору в сфере
здравоохранения и социального развития
в соответствии с требованиями
законодательства Российской Федерации.
При организации проведения экспертизы
качества, эффективности и безопасности
лекарственных средств не допускается
передача каких-либо государственных
функций экспертным организациям или
экспертам.
1.3. Основными принципами
организации экспертизы качества,
эффективности и безопасности
лекарственных средств являются:
1)
независимость и правовая защищенность
субъектов экспертизы при осуществлении
ими своей профессиональной
деятельности;
2)
научный подход, полнота, всесторонность
и объективность исследований объектов
экспертизы, обеспечение обоснованности
результатов экспертизы в соответствии с
документально установленными
критериями приемлемости;
3)
компетентность и высокий
профессиональный уровень экспертных
организаций и экспертов;
4)
системность организации экспертной
работы и ее методического обеспечения;
5)
ориентация на мировой уровень развития
науки и техники, нормы и правила
экологической, технической и
общественной безопасности, на
обязательность выполнения требований
законодательства Российской Федерации и
применимых международных и национальных
стандартов;
6)
гласность результатов экспертизы при
условии сохранения государственной,
служебной и коммерческой тайны в
соответствии с законодательством
Российской Федерации.
1.4. Все документы при
проведении экспертизы качества,
эффективности и безопасности
лекарственных средств должны
исполняться на русском языке.
1.5. Научные и иные
организации, ученые и специалисты (далее
- экспертные организации и эксперты,
соответственно) привлекаются
Федеральной службой по надзору в сфере
здравоохранения и социального развития
для проведения экспертизы качества,
эффективности и безопасности
лекарственных средств на основе
договоров.
Проводящие экспертизу качества,
эффективности и безопасности
лекарственных средств экспертные
организации (эксперты) не должны иметь
заинтересованность в результатах
экспертизы.
1.6. При организации
экспертизы в целях обеспечения ее
результативности, качества и соблюдения
основных принципов проведения
Федеральная служба по надзору в сфере
здравоохранения и социального развития
принимает во внимание компетентность и
профессионализм экспертных организаций
и экспертов, системность организации
экспертной работы, обеспечивает
методическое сопровождение
деятельности по проведению экспертизы
качества, эффективности и безопасности
лекарственных средств в порядке,
определяемом условиями заключенных
договоров и внутренними
распорядительными актами Федеральной
службы по надзору в сфере
здравоохранения и социального
развития.
1.7. Экспертиза качества,
эффективности и безопасности
лекарственных средств проводится на
основе заданий на проведение экспертизы,
определяющих объект (объекты) экспертизы
и критерии его (их) оценки. Задания на
проведение экспертизы могут быть общими
и частными. Общее задание выдается
экспертной организации на определенный
период времени и устанавливает ее
полномочия по проведению определенного
вида экспертизы в течение указанного
срока. Частное задание выдается
экспертной организации на разовое
проведение конкретного вида экспертизы.
Задания на проведение экспертизы
утверждаются руководителем Федеральной
службы по надзору в сфере
здравоохранения и социального развития
или должностным лицом, специально
уполномоченным для этой цели.
1.8. Частное задание на
проведение экспертизы качества,
эффективности и безопасности
лекарственных средств должно включать в
себя:
1)
определение вида и объекта экспертизы;
2)
срок проведения экспертизы;
3)
возможные особенности проведения
экспертизы;
4)
другие сведения, необходимые для
проведения экспертизы.
1.9. Общее задание на
проведение экспертизы качества,
эффективности и безопасности
лекарственных средств должно включать в
себя:
1)
определение вида и объекта экспертизы;
2)
срок действия полномочий экспертной
организации (или эксперта);
3)
правила проведения данного вида
экспертных работ;
4)
другие сведения, необходимые для
проведения экспертизы.
1.10. Заключением экспертизы
качества, эффективности и безопасности
лекарственных средств является
документ, содержащий основные выводы по
объекту экспертизы. Заключение должно
быть обоснованным и недвусмысленно
отвечать на поставленные в задании перед
экспертной организацией (экспертом)
вопросы. К заключению должны (при
наличии) прилагаться изложенные в
произвольной форме особые мнения
экспертов, не согласных с принятым
заключением.
Заключение экспертизы по объекту
ее проведения может быть положительным
или отрицательным, о чем в
постановляющей части заключения должна
быть соответствующая формулировка.
Заключение экспертизы должно
храниться в течение срока не менее 10 лет
при условии, что большие сроки не
устанавливаются иными нормативными
правовыми актами.
По решению руководителя
Федеральной службы по надзору в сфере
здравоохранения и социального развития
информация, содержащаяся в заключении
экспертизы качества, эффективности и
безопасности лекарственных средств,
может публиковаться при условии
соблюдения требований по безопасности
сведений, составляющих государственную,
служебную, коммерческую или иную тайну.
1.11. Серьезными нарушениями
правил проведения экспертизы качества,
эффективности и безопасности
лекарственных средств являются:
1)
непредставление экспертной организации
(эксперту) информации, необходимой для
проведения экспертизы;
2)
фальсификация материалов, сведений и
данных, представляемых на экспертизу, а
также сведений о результатах ее
проведения;
3)
принуждение экспертной организации
(эксперта) к подготовке заведомо ложного
заключения экспертизы;
4)
создание препятствий проведению
экспертизы;
5)
необоснованность выводов экспертизы;
6)
фальсификация выводов экспертизы;
7)
сокрытие от Федеральной службы по
надзору в сфере здравоохранения и
социального развития оснований для
отвода экспертной организации (эксперта)
вследствие возникновения
заинтересованности экспертной
организации (эксперта) в результатах
экспертизы;
8)
прямое или косвенное вмешательство в
процесс экспертизы в целях оказания
влияния на ход и результаты экспертизы;
9)
иные нарушения, ответственность за
которые наступает в соответствии с
законодательством Российской
Федерации.
1.12. В целях обеспечения
возможности организации проведения
экспертизы качества в виде выборочного
государственного контроля
лекарственных средств
организации-производители и импортеры
должны ежемесячно направлять в
Федеральную службу по надзору в сфере
здравоохранения и социального развития
перечень серий лекарственных средств,
выпущенных ими в обращение на территории
Российской Федерации.
1.13. Организация проведения
экспертизы качества, эффективности и
безопасности лекарственных средств
включает в себя следующие
административные процедуры:
1)
организация проведения экспертизы
качества, эффективности и безопасности,
осуществляемой в ходе рассмотрения
документов и принятия решения о
государственной регистрации
лекарственного средства (при
регистрации лекарственных средств).
Основание: статья 19 Федерального закона
от 22.06.98 N 86-ФЗ "О лекарственных средствах";
п.5.2 Положения о Федеральной службе по
надзору в сфере здравоохранения и
социального развития, утвержденного
постановлением Правительства
Российской Федерации от 30.06.2004 N 323;
2)
осуществление сбора и анализа
информации о побочных эффектах
применения лекарственных средств.
Основания: статья 41 Федерального закона
от 22.06.98 N 86-ФЗ "О лекарственных средствах";
п.5.1.3.5 Положения о Федеральной службе по
надзору в сфере здравоохранения и
социального развития, утвержденного
постановлением Правительства
Российской Федерации от 30.06.2004 N 323;
3)
организация проведения экспертизы
качества при осуществлении
предварительного государственного
контроля лекарственных средств.
Основание: статья 8 Федерального закона
от 22.06.98 N 86-ФЗ "О лекарственных средствах".
Осуществляется для впервые производимых
и впервые ввозимых на территорию
Российской Федерации лекарственных
средств; для лекарственных средств,
выпускаемых по измененной технологии;
для лекарственных средств, выпускаемых
после перерыва производства данного
лекарственного средства от трех лет и
более; для иных лекарственных средств
вследствие выявления ухудшения их
качества;
4)
организация проведения экспертизы
качества при осуществлении выборочного
государственного контроля
лекарственных средств. Основание: статья
8 Федерального закона от 22.06.98 N 86-ФЗ "О
лекарственных средствах".
Осуществляется на основании планов
выборочного контроля качества
Федеральной службы по надзору в сфере
здравоохранения и социального развития,
формируемого по результатам сбора и
анализа информации о качестве
лекарственных средств;
5)
организация проведения экспертизы
качества при осуществлении повторного
выборочного государственного контроля
лекарственных средств. Основание: статья
8 Федерального закона от 22.06.98 N 86-ФЗ "О
лекарственных средствах".
Осуществляется в случае возникновения
сомнений в качестве лекарственных
средств у субъекта обращения
лекарственных средств;
6)
осуществление сбора и анализа
информации о качестве лекарственных
средств. Основание: п.5.1.3.5 Положения о
Федеральной службе по надзору в сфере
здравоохранения и социального развития,
утвержденного постановлением
Правительства Российской Федерации от
30.06.2004 N 323.
II. Требования к порядку исполнения государственной функции
2.1. Порядок информирования о
государственной функции по организации
проведения экспертизы качества,
эффективности и безопасности
лекарственных средств:
2.1.1. Документом,
результирующим проведение экспертизы
качества, эффективности и безопасности
лекарственного средства, является
экспертное заключение, которое
используется Федеральной службой по
надзору в сфере здравоохранения и
социального развития при исполнении
соответствующих государственных
контрольно-надзорных функций.
2.1.2. Направление документов
и данных для организации проведения
экспертизы качества, эффективности и
безопасности лекарственных средств
производится по адресу: Федеральная
служба по надзору в сфере
здравоохранения и социального развития,
отдел, осуществляющий регистрацию
лекарственных средств: 109074, г.Москва,
Славянская площадь, д.4, строение 1. Время
работы: в будние дни с 9-00 до 18-00.
Место приема документов должно
быть оснащено телефоном, компьютером с
возможностью выхода в Интернет и текстом
настоящего регламента.
Телефоны для справок и
предварительной записи: +7 (495) 298-4070; +7 (495)
298-4069.
Адрес электронной почты:
общий: qc@roszdravnadzor.ru;
для передачи организациями
перечней серий лекарственных средств,
выпущенных ими в обращение на территории
Российской Федерации:
qc-release@roszdravnadzor.ru.
Общая справочная служба: +7 (495)
298-4628.
Информация об итогах проведения
экспертизы качества, эффективности и
безопасности лекарственных средств
может быть получена на официальном
интернет-сайте: www.roszdravnadzor.ru.
2.1.3. Перечни документов,
представляемых для организации
проведения экспертизы качества,
эффективности и безопасности
лекарственных средств, и требования к
таким документам представлены в
соответствующих разделах
административных процедур настоящего
Регламента.
2.2. Условия и сроки
исполнения государственной функции по
организации проведения экспертизы
качества, эффективности и безопасности
лекарственных средств представлены в
соответствующих разделах
административных процедур настоящего
Регламента.
Организация проведения экспертизы
качества лекарственного средства в виде
предварительного государственного
контроля осуществляется в срок, не
превышающий 40 дней с даты отбора
образцов, но не более 50 дней с даты
получения комплекта соответствующих
документов и данных (без учета времени,
затраченного обратившейся организацией
на наработку трех опытно-промышленных
серий лекарственного средства) при
условии соблюдения требований к их
составу и содержанию.
Организация проведения
экспертизы качества лекарственного
средства в виде повторного выборочного
государственного контроля
осуществляется в срок, не превышающий 40
дней с даты отбора образцов, но не более 50
дней с даты получения комплекта
соответствующих документов и данных при
условии соблюдения требований к их
составу и содержанию.
2.3. Основания для отказа в
рассмотрении документов или организации
проведения экспертизы качества,
эффективности и безопасности
лекарственных средств содержатся в
соответствующих разделах
административных процедур настоящего
Регламента.
2.4. Действия или бездействие
Федеральной службы по надзору в сфере
здравоохранения и социального развития
в связи с организацией проведения
экспертизы качества, эффективности и
безопасности лекарственных средств
могут быть обжалованы в установленном
порядке. Министр здравоохранения и
социального развития Российской
Федерации отменяет противоречащие
федеральному законодательству решения
Федеральной службы по надзору в сфере
здравоохранения и социального развития,
если иной порядок отмены решений не
установлен федеральным законом.
III. Административные процедуры
3.1. Структура и взаимосвязи
административных процедур, выполняемых
при организации проведения экспертизы
качества, эффективности и безопасности
лекарственных средств, приведены на
схеме (приложение 1).
3.2. Руководители
подразделений Федеральной службы по
надзору в сфере здравоохранения и
социального развития, отвечающих в
соответствии с настоящим Регламентом за
организацию проведения экспертизы
качества, эффективности и безопасности
лекарственных средств, должны
организовать документированный учет
выполнения каждого этапа
административных процедур с указанием
даты завершения его исполнения и подписи
ответственного лица.
3.3. Административная
процедура "Организация проведения
экспертизы качества, эффективности и
безопасности лекарственных средств (при
государственной регистрации)"
осуществляется по необходимости только
в ходе выполнения административных
процедур "Рассмотрение документов и
принятие решения о государственной
регистрации лекарственных средств",
"Внесение изменений в регистрационную
документацию на лекарственные средства",
"Рассмотрение фактов и обстоятельств,
создающих угрозу для жизни и здоровья
людей при применении зарегистрированных
лекарственных средств"
Административного регламента
Федеральной службы по надзору в сфере
здравоохранения и социального развития
"Государственная регистрация
лекарственных средств" в соответствии с
нижеследующим порядком (схема
осуществления административной
процедуры приведена в приложении 2):
3.3.1. Экспертиза качества и
(или) эффективности и (или) безопасности
лекарственных средств производится при
наличии следующих оснований:
- при отсутствии достаточных
экспертных заключений в отношении
данных о производстве лекарственного
средства, и (или) методов контроля
качества лекарственного средства, и (или)
результатов доклинических исследований
лекарственного средства, и (или)
результатов фармакологических и
токсикологических исследований
лекарственного средства, и (или)
результатов клинических исследований
лекарственного средства (с учетом целей
проведения экспертизы);
- при недостаточной обоснованности
и (или) неоднозначном характере
представленных в документах и данных
результатов оценки качества,
эффективности и безопасности
лекарственного средства;
-
при противоречивости имеющихся
экспертных заключений (производится
обязательное назначение дополнительной
экспертизы).
3.3.2. При наличии оснований
должностное лицо, отвечающее за
выполнение соответствующей процедуры
(ответственный исполнитель), готовит
проект задания на проведение экспертизы
качества, эффективности и безопасности
лекарственного средства с указанием
организации(й), которая(ые) будет(ут)
проводить экспертизу, предельных сроков
выполнения работ и вопросов, по которым
предстоит получить экспертное
заключение. Проект задания
согласовывается начальником отдела,
осуществляющего регистрацию
лекарственных средств, и утверждается
лицом, уполномоченным для этой цели
руководителем Федеральной службы по
надзору в сфере здравоохранения и
социального развития. Подготовка и
утверждение задания осуществляется в
течение 3 рабочих дней с даты определения
необходимости в проведении экспертизы.
3.3.3. Экспертная организация
(экспертные организации) проводит(ят)
экспертизу качества, эффективности и
безопасности лекарственных средств на
основании задания в сроки, определяемые
заданием и общими сроками выполнения
административных процедур, в рамках
которых организуется проведение
экспертизы. Ответственность за контроль
хода проведения экспертизы несет
начальник отдела, осуществляющего
регистрацию лекарственных средств.
Образцы субстанций для проведения
экспертизы качества с целью регистрации
лекарственного средства направляются с
сопроводительным письмом, в котором
указывается вид контроля качества
лекарственных средств, и документом,
подтверждающим качество субстанции
организации-производителя.
3.3.4. Приемку заключения(й)
экспертной(ых) организации(й) по всем
вопросам, указанным в задании,
осуществляет начальник отдела,
осуществляющего регистрацию
лекарственных средств, и в течение 5
рабочих дней с даты приемки передает его
ответственному исполнителю.
Ответственный исполнитель осуществляет
дальнейшее использование заключения
экспертизы в соответствии с
требованиями административных процедур,
в связи с выполнением которых было
принято решение о проведении экспертизы
качества, эффективности и безопасности
лекарственного средства.
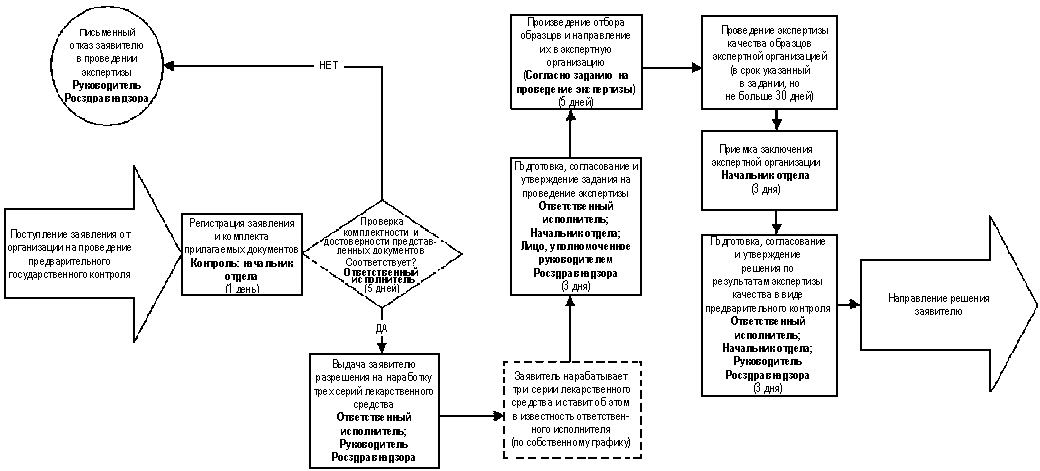
3.4. Административная процедура "Организация проведения экспертизы качества при осуществлении предварительного государственного контроля лекарственных средств" выполняется в связи с поступлением от организации комплекта соответствующих документов и данных в соответствии с нижеследующим порядком (схема осуществления административной процедуры приведена в приложении 3):
3.4.1. Документы и данные,
предназначенные для организации
проведения экспертизы качества при
осуществлении предварительного
государственного контроля
лекарственных средств, поступившие от
организации, регистрируются в течение 1
рабочего дня с даты получения. Комплект
документов может быть направлен по почте
заказным письмом (бандеролью) с описью
вложения и уведомлением о вручении.
Контроль ведения учета документов
осуществляет начальник отдела,
осуществляющего контроль производства
лекарственных средств.
3.4.2. Лицо, назначенное
начальником отдела, осуществляющего
контроль производства лекарственных
средств (ответственный исполнитель),
проверяет комплектность представленных
документов и данных, в состав которых
должны входить:
- сопроводительное письмо;
- заверенная руководителем
организации копия согласованного в
установленном порядке технологического
регламента производства лекарственного
средства;
- копия аттестата контрольных
лабораторий ОКК
организации-производителя на
техническую компетентность в области
контроля качества производимых
лекарственных средств (при наличии);
- информация об используемой
субстанции (производитель, реквизиты
регистрационного удостоверения,
государственного стандарта качества
(нормативной документации).
Требовать от организации
представления иных документов и данных
не допускается. При необходимости
установить достоверность сведений о
государственной регистрации или о
наличии утвержденного государственного
стандарта качества (нормативной
документации) на лекарственное средство
эти данные могут быть получены
ответственным исполнителем в архиве
Росздравнадзора.
При отсутствии замечаний к
комплектности представленных
организацией документов и данных в
течение 5 рабочих дней с даты регистрации
комплекта документов и данных выдается
разрешение на наработку трех
опытно-промышленных серий
лекарственного средства.
При наличии замечаний к
комплектности представленных
организацией документов и данных
ответственный исполнитель готовит
письменный отказ в проведении
экспертизы качества при осуществлении
предварительного государственного
контроля лекарственных средств с
указанием причин отказа, который
подписывается руководителем
Федеральной службы по надзору в сфере
здравоохранения и социального развития
и направляется в обратившуюся
организацию.
3.4.3. На основании
полученного разрешения обратившаяся
организация в соответствии со своим
собственным графиком осуществляет
наработку трех опытно-промышленных
серий лекарственного средства и по
завершении письменно ставит в
известность ответственного исполнителя
о своей готовности предоставить образцы
для осуществления предварительного
государственного контроля качества
лекарственного средства.
3.4.4. Ответственный
исполнитель готовит проект задания на
проведение экспертизы качества с
указанием организации, которая будет
проводить экспертизу, предельных сроков
выполнения работ и вопросов, по которым
предстоит получить экспертное
заключение. В задании также должно быть
указано, кто отвечает за отбор образцов.
Проект задания согласовывается
начальником отдела, осуществляющего
контроль производства лекарственных
средств, и утверждается лицом,
уполномоченным для этой цели
руководителем Федеральной службы по
надзору в сфере здравоохранения и
социального развития. Подготовка и
утверждение задания осуществляется в
течение 3 рабочих дней с даты готовности
обратившейся организации предоставить
образцы.
3.4.5. В зависимости от
обозначенного в задании на проведение
экспертизы, отбор образцов может
производиться представителями
территориальных управлений
Росздравнадзора, ведомственных
учреждений Росздравнадзора, экспертных
организаций. Отбор образцов
лекарственных средств и передача их в
экспертную организацию производится в
течение 5 рабочих дней с даты утверждения
задания на проведение экспертизы.
Особые требования к образцам,
порядку их отбора и направления в ходе
организации проведения экспертизы
качества при осуществлении
предварительного государственного
контроля лекарственных средств:
- отбор образцов отечественных
лекарственных средств осуществляется с
участием представителей отдела контроля
качества организации-производителя;
- образцы лекарственных средств
направляются в упаковке и с маркировкой,
предусмотренной государственным
стандартом качества (нормативной
документацией); образцы субстанций - в
таре из стекла;
- образцы лекарственных средств
направляются с сопроводительным
письмом, в котором указывается вид
контроля качества лекарственных
средств, вместе с документом,
подтверждающим качество лекарственного
средства организации-производителя, и
актом отбора образцов лекарственных
средств;
- образцы лекарственных средств
направляются в количестве, достаточном
для проведения трех анализов в
соответствии с требованиями
государственного стандарта качества
лекарственного средства (нормативной
документации) (с учетом испытания на
микробиологическую чистоту);
- образцы лекарственных средств для
инъекций и глазных капель направляются с
учетом испытаний показателя
"механические включения", а образцы
лекарственного растительного сырья - с
учетом результатов радиационного
контроля;
-
образцы готовых лекарственных средств и
образцы субстанций должны
сопровождаться стандартными образцами
субстанций и веществ, необходимых для
проведения контроля в соответствии с
государственными стандартами качества
(нормативной документацией), и
оригиналом или заверенной копией
документа, подтверждающего качество
стандартного образца
организации-производителя;
- образцы лекарственных средств
направляются вместе с образцом
субстанции, из которой они изготовлены.
Образцы субстанции направляются в
количестве, достаточном для проведения
двух анализов в соответствии с
утвержденным государственным
стандартом качества (нормативной
документацией); образцы субстанций, из
которых произведены лекарственные
средства отечественными
организациями-производителями, должны
сопровождаться документами,
подтверждающими качество субстанций,
выданных производителем субстанции и
производителем лекарственного средства
по результатам входного контроля
качества;
- образцы лекарственных средств,
оставшиеся после проведения контроля
качества лекарственных средств,
хранятся не менее 6 месяцев, после чего
образцы лекарственных средств, не
удовлетворяющие требованиям
государственного стандарта качества
(нормативной документации), подлежат
уничтожению в установленном порядке;
образцы лекарственных средств,
удовлетворяющие требованиям
государственных стандартов качества
(нормативной документации), возвращаются
организациям-производителям по их
письменной просьбе.
3.4.6. На основании
полученного задания экспертная
организация проводит экспертизу
качества образцов в срок, определяемый
заданием, но не превышающий 30 дней с даты
получения образцов экспертной
организацией. Ответственность за
контроль хода проведения экспертизы
несет начальник отдела, осуществляющего
контроль производства лекарственных
средств.
3.4.7. Приемку заключения
экспертной организации по всем вопросам,
указанным в задании, осуществляет
начальник отдела, осуществляющего
контроль производства лекарственных
средств, и в течение 3 рабочих дней с даты
приемки передает его ответственному
исполнителю.
3.4.8. На основании заключения
экспертизы ответственный исполнитель в
течение 3 рабочих дней с даты его
получения готовит проект решения по
результатам экспертизы качества при
осуществлении предварительного
государственного контроля
лекарственных средств, согласовывает
его с начальником отдела,
осуществляющего контроль производства
лекарственных средств. Окончательное
решение по результатам экспертизы
качества при осуществлении
предварительного государственного
контроля лекарственных средств
принимает руководитель Федеральной
службы по надзору в сфере
здравоохранения и социального
развития.
3.4.9. В случае положительного
решения Федеральной службы по надзору в
сфере здравоохранения и социального
развития по результатам
предварительного государственного
контроля три подвергшиеся контролю
серии лекарственных средств могут быть
выпущены в обращение после прохождения
обязательной сертификации без
повторного отбора образцов.
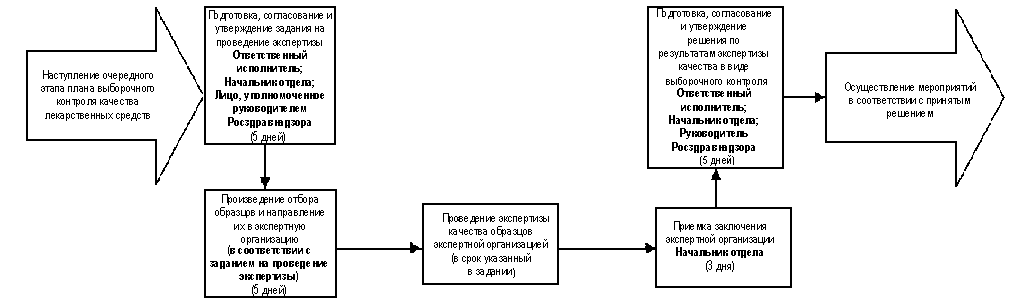
3.5. Административная
процедура "Организация проведения
экспертизы качества при осуществлении
выборочного государственного контроля
лекарственных средств" выполняется на
основании плана выборочного контроля
качества лекарственных средств,
формируемого в ходе выполнения
административной процедуры
"Осуществление сбора и анализа
информации о качестве лекарственных
средств" настоящего Регламента в
соответствии с нижеследующим порядком
(схема осуществления административной
процедуры приведена в приложении 4):
3.5.1. В течение 5 дней с даты
наступления очередного этапа выполнения
плана выборочного контроля качества
лекарственных средств и на основании
перечня лекарственных средств,
подлежащих выборочному контролю,
ответственный исполнитель, назначенный
начальником отдела, осуществляющего
контроль обращения лекарственных
средств, готовит проект задания на
проведение экспертизы качества с
указанием организации, которая будет
проводить экспертизу, предельных сроков
выполнения работ и вопросов, по которым
предстоит получить экспертное
заключение. В задании также должно быть
указано, кто отвечает за отбор образцов.
Проект задания согласовывается
начальником отдела, осуществляющего
контроль обращения лекарственных
средств, и утверждается лицом,
уполномоченным для этой цели
руководителем Федеральной службы по
надзору в сфере здравоохранения и
социального развития.
3.5.2. В зависимости от
обозначенного в задании на проведение
экспертизы отбор образцов может
производиться представителями
территориальных управлений
Росздравнадзора, ведомственных
учреждений Росздравнадзора, экспертных
организаций. Отбор образцов
лекарственных средств и передача их в
экспертную организацию производится в
течение 5 рабочих дней с даты утверждения
задания на проведение экспертизы.
Особые требования к образцам,
порядку их отбора и направления в ходе
организации проведения экспертизы
качества при осуществлении выборочного
государственного контроля
лекарственных средств:
-
отбор образцов отечественных
лекарственных средств осуществляется со
складов или в аптечных организациях с
участием представителей отдела контроля
качества организации-производителя;
- отбор образцов зарубежных
лекарственных средств проводится со
складов или в аптечных организациях на
территории Российской Федерации,
указанных организацией, поименованной в
регистрационном удостоверении на данное
лекарственное средство, либо другим
лицом по его поручению;
- отбор образцов лекарственных
средств может проводиться при проверках
организации-производителя с целью
инспектирования качества лекарственных
средств;
- образцы лекарственных средств
направляются в упаковке,
предусмотренной государственным
стандартом качества (нормативной
документацией); образцы субстанций - в
таре из стекла. Маркировка образцов
лекарственных средств должна
соответствовать требованиям
государственных стандартов качества
(нормативной документации);
- образцы лекарственных средств
направляются с сопроводительным
письмом, в котором указывается вид
контроля качества лекарственных
средств, вместе с документом,
подтверждающим качество лекарственного
средства организации-производителя и
актом отбора образцов лекарственных
средств;
- образцы лекарственных средств
направляются в количестве, достаточном
для проведения трех анализов в
соответствии с требованиями
государственного стандарта качества
лекарственного средства (нормативной
документации) (с учетом испытания на
микробиологическую чистоту);
- образцы лекарственных средств для
инъекций и глазных капель направляются с
учетом испытаний показателя
"механические включения", а образцы
лекарственного растительного сырья - с
учетом результатов радиационного
контроля;
- образцы готовых лекарственных
средств и образцы субстанций должны
сопровождаться стандартными образцами
субстанций и веществ, необходимых для
проведения контроля в соответствии с
государственными стандартами качества
(нормативной документацией) и оригиналом
или заверенной копией документа,
подтверждающего качество стандартного
образца организации-производителя;
- образцы отечественных
лекарственных средств направляются с
архивным образцом субстанции в
количестве, достаточном для проведения
двух анализов в соответствии с
утвержденным государственным
стандартом качества (нормативной
документацией);
-
образцы лекарственных средств должны
сопровождаться заверенной копией
сертификата соответствия
лекарственного средства с протоколом
анализа либо другого документа,
свидетельствующего о качестве
лекарственного средства;
- образцы субстанций, из которых
произведены лекарственные средства
отечественными
организациями-производителями, должны
сопровождаться документами,
подтверждающими качество субстанций,
выданных производителем субстанции и
производителем лекарственного средства
по результатам входного контроля
качества;
- образцы лекарственных средств,
оставшиеся после проведения
государственного контроля качества
лекарственных средств, хранятся не менее
6 месяцев, после чего образцы
лекарственных средств, не
удовлетворяющие требованиям
государственного стандарта качества
(нормативной документации), подлежат
уничтожению в установленном порядке;
образцы лекарственных средств,
удовлетворяющие требованиям
государственных стандартов качества
(нормативной документации), возвращаются
организациям-производителям по их
письменной просьбе либо используются в
научно-исследовательских целях.
3.5.3. На основании
полученного задания экспертная
организация проводит экспертизу
качества образцов в срок, определяемый
заданием. Ответственность за контроль
хода проведения экспертизы несет
начальник отдела, осуществляющего
контроль обращения лекарственных
средств.
3.5.4. Приемку заключения
экспертной организации по всем вопросам,
указанным в задании, осуществляет
начальник отдела, осуществляющего
контроль обращения лекарственных
средств, и в течение 3 рабочих дней с даты
приемки передает его ответственному
исполнителю.
3.5.5. На основании заключения
экспертизы ответственный исполнитель в
течение 5 рабочих дней с даты его
получения готовит проект решения по
результатам экспертизы качества при
осуществлении выборочного
государственного контроля
лекарственных средств, согласовывает
его с начальником отдела,
осуществляющего контроль обращения
лекарственных средств. В том случае, если
возникает необходимость прекращения
обращения серии какого-либо
лекарственного средства, окончательное
решение об этом принимает руководитель
Федеральной службы по надзору в сфере
здравоохранения и социального
развития.
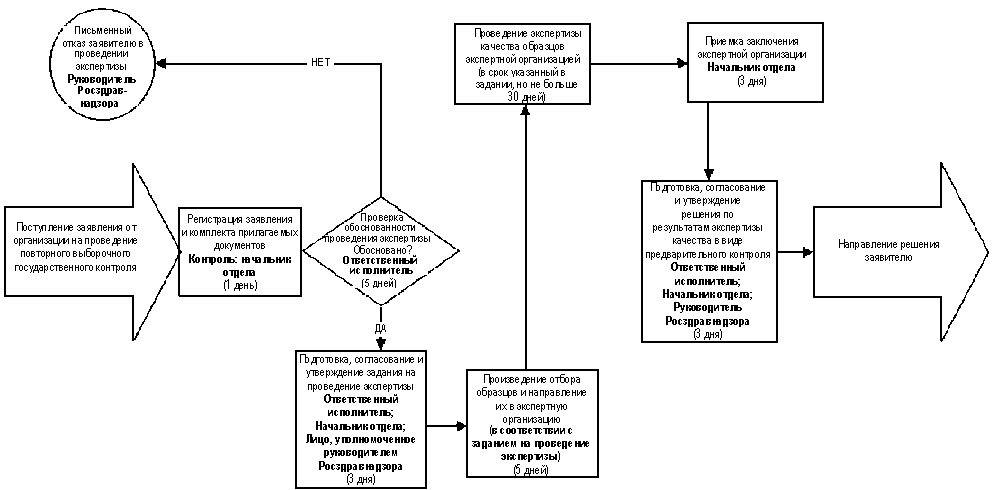
3.6. Административная процедура "Организация проведения экспертизы качества при осуществлении повторного выборочного государственного контроля лекарственных средств" выполняется в случаях возникновения сомнений в качестве лекарственных средств у субъекта обращения лекарственных средств в связи с поступлением от него комплекта соответствующих документов и данных в соответствии с нижеследующим порядком (схема осуществления административной процедуры приведена в приложении 5):
3.6.1. Документы и данные,
содержащие сведения, дающие основания
для сомнений в качестве лекарственного
средства и предназначенные для
проведения экспертизы качества в виде
повторного выборочного
государственного контроля
лекарственных средств, поступившие от
организации, регистрируются в течение 1
рабочего дня с даты получения. Комплект
документов может быть направлен по почте
заказным письмом (бандеролью) с описью
вложения и уведомлением о вручении.
Контроль за ведением учета документов
осуществляет начальник отдела,
осуществляющего контроль производства
лекарственных средств.
3.6.2. Лицо, назначенное
начальником отдела, осуществляющего
контроль производства лекарственных
средств, - ответственный исполнитель в
течение 5 рабочих дней с даты регистрации
документов проверяет обоснованность
проведения экспертизы качества.
Надлежащим основанием считается
выявление несоответствия показателей
качества лекарственного средства
требованиям государственного стандарта
качества (нормативной документации) и
несогласие с этим
организации-производителя или
импортера.
При отсутствии надлежащих
оснований ответственный исполнитель
готовит письменный отказ в проведении
экспертизы качества при осуществлении
повторного выборочного
государственного контроля
лекарственных средств с указанием
оснований отказа, который подписывается
руководителем Федеральной службы по
надзору в сфере здравоохранения и
социального развития и направляется в
обратившуюся организацию.
3.6.3. При наличии надлежащих
оснований ответственный исполнитель
готовит проект задания на проведение
экспертизы качества лекарственного
средства с указанием организации,
которая будет проводить экспертизу,
предельных сроков выполнения работ и
вопросов, по которым предстоит получить
экспертное заключение. В задании также
должно быть указано, кто отвечает за
отбор образцов. Проект задания
согласовывается начальником отдела,
осуществляющего контроль производства
лекарственных средств, и утверждается
лицом, уполномоченным для этой цели
руководителем Федеральной службы по
надзору в сфере здравоохранения и
социального развития. Подготовка и
утверждение задания на проведение
экспертизы качества при осуществлении
повторного выборочного
государственного контроля производится
в течение 3 рабочих дней.
3.6.4. В зависимости от
обозначенного в задании на проведение
экспертизы отбор образцов может
производиться представителями
территориальных управлений
Росздравнадзора, ведомственных
учреждений Росздравнадзора, экспертных
организаций. Отбор образцов
лекарственных средств и передача их в
экспертную организацию производится в
течение 5 рабочих дней с даты утверждения
задания на проведение экспертизы.
Особые требования к
образцам, порядку их отбора и передачи в
ходе организации проведения экспертизы
качества при осуществлении повторного
выборочного государственного контроля
лекарственных средств:
- субъект обращения лекарственных
средств на территории Российской
Федерации, выявивший несоответствие
лекарственных средств требованиям
государственного стандарта качества
(нормативной документации), представляет
образцы несоответствующего
лекарственного средства в количестве,
достаточном для проведения необходимых
анализов;
- отбор образцов осуществляется из
архивных образцов лекарственных средств
ОКК организации-производителя;
- образцы лекарственных средств
направляются в упаковке,
предусмотренной государственным
стандартом качества (нормативной
документацией); образцы субстанций - в
таре из стекла; маркировка образцов
лекарственных средств должна
соответствовать требованиям
государственных стандартов качества
(нормативной документации);
- образцы лекарственных средств
направляются с сопроводительным
письмом, в котором указывается вид
контроля качества лекарственных
средств, вместе с документом,
подтверждающим качество лекарственного
средства организации-производителя и
актом отбора образцов лекарственных
средств;
- образцы лекарственных средств для
инъекций и глазных капель направляются с
учетом испытаний показателя
"механические включения", а образцы
лекарственного растительного сырья - с
учетом результатов радиационного
контроля;
- организация-производитель
направляет образцы лекарственных
средств в ненарушенной упаковке;
- количество образцов
лекарственных средств, направляемых на
повторный выборочный контроль качества
по показателям "механические включения"
и "радиационный контроль", определяется
соответствующими государственными
стандартами качества (нормативной
документацией);
- образцы лекарственных средств
должны сопровождаться заверенной копией
сертификата соответствия
лекарственного средства с протоколом
анализа либо другого документа,
свидетельствующего о качестве
лекарственного средства;
- стандартные образцы субстанции,
должны сопровождаться оригиналом или
заверенной копией документа,
подтверждающего качество стандартного
образца организации-производителя;
-
образцы лекарственных средств,
оставшиеся после проведения
государственного контроля качества
лекарственных средств, хранятся не менее
6 месяцев, после чего образцы
лекарственных средств, не
удовлетворяющие требованиям
государственного стандарта качества
(нормативной документации), подлежат
уничтожению в установленном порядке;
образцы лекарственных средств,
удовлетворяющие требованиям
государственных стандартов качества
(нормативной документации), возвращаются
организациям-производителям по их
письменной просьбе либо используются в
научно-исследовательских целях.
3.6.5. На основании
полученного задания экспертная
организация проводит экспертизу
качества образцов в срок, определяемый
заданием, но не превышающий 30 дней с даты
получения образцов экспертной
организацией. Ответственность за
контроль хода проведения экспертизы
несет начальник отдела, осуществляющего
контроль производства лекарственных
средств.
3.6.6. Приемку заключения
экспертной организации по всем вопросам,
указанным в задании, осуществляет
начальник отдела, осуществляющего
контроль производства лекарственных
средств, и в течение 3 рабочих дней с даты
приемки передает его ответственному
исполнителю.
3.6.7. На основании заключения
экспертизы ответственный исполнитель в
течение 3 рабочих дней с даты его
получения готовит проект решения по
результатам экспертизы качества,
согласовывает его с начальником отдела,
осуществляющего контроль производства
лекарственных средств. Решение по
результатам экспертизы качества при
осуществлении повторного выборочного
государственного контроля принимает
руководитель Федеральной службы по
надзору в сфере здравоохранения и
социального развития.
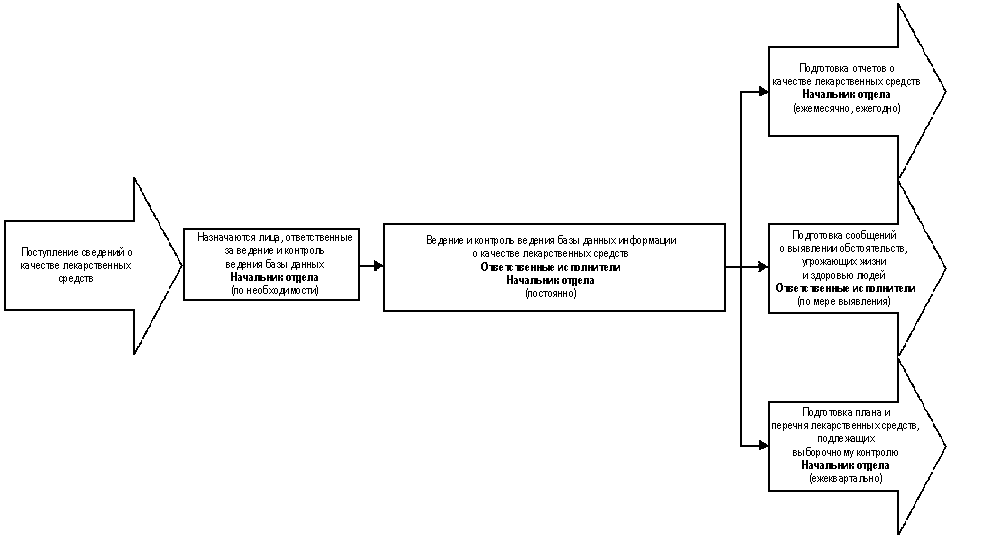
3.7. Административная
процедура "Осуществление сбора и анализа
информации о качестве лекарственных
средств" осуществляется постоянно в
соответствии с нижеследующим порядком
(схема осуществления административной
процедуры приведена в приложении 6):
3.7.1. Лица, ответственные за
ведение базы данных и за контроль
ведения базы данных информации о
качестве лекарственных средств, по мере
необходимости назначаются начальником
отдела, осуществляющего сбор и анализ
информации о качестве лекарственных
средств, из числа сотрудников отдела.
3.7.2. Источниками
документированных сведений о качестве
лекарственных средств при осуществлении
сбора и анализа информации являются:
- перечни серий лекарственных
средств, выпущенных в обращение
организациями-производителями или
импортерами, направляемые в
соответствии с требованиями п.1.12
настоящего Регламента;
- результаты экспертизы качества в
виде предварительного государственного
контроля лекарственных средств;
- результаты экспертизы качества в
виде выборочного государственного
контроля лекарственных средств;
- результаты экспертизы качества в
виде повторного выборочного
государственного контроля
лекарственных средств;
- информация о качестве
лекарственных средств, полученная в ходе
сбора и анализа информации о побочных
эффектах применения лекарственных
средств;
- информация о качестве
лекарственных средств, полученная в ходе
работы с обращениями частных лиц,
предпринимательских, государственных и
общественных организаций.
Сбор, обработка, анализ поступающих
сведений, внесение изменений в базу
данных информации о качестве
лекарственных средств и контроль
ведения базы данных должны
осуществляться соответствующими
ответственными лицами постоянно.
3.7.3. На основании полученных
сведений о качестве лекарственных
средств начальник отдела,
осуществляющего сбор и анализ
информации о качестве лекарственных
средств, организует подготовку:
- ежемесячных отчетов о качестве
лекарственных средств;
- ежегодных отчетов о качестве
лекарственных средств.
3.7.4. На основании полученных
сведений о качестве лекарственных
средств начальник отдела,
осуществляющего сбор и анализ
информации о качестве лекарственных
средств, организует подготовку
ежеквартально обновляемого плана и
перечня лекарственных средств,
подлежащих выборочному
государственному контролю, с учетом
следующих факторов:
- частота проблем с качеством
лекарственного средства;
-
частота проблем с качеством
лекарственных средств конкретного
производителя;
- потенциальная опасность
лекарственного средства (средства с
высокой опасностью - стерильные
лекарственные средства для
парентерального введения, детские
лекарственные средства, лекарственные
средства, предназначенные для
длительного использования);
- включение лекарственного
средства в перечень дополнительного
лекарственного обеспечения граждан,
имеющих право на получение
государственной социальной помощи.
3.7.5. По мере выявления в ходе
сбора и анализа информации о качестве
лекарственных средств обстоятельств,
угрожающих жизни и здоровью людей при
приеме лекарственных средств,
ответственные лица обязаны немедленно
сообщать об этом руководству
Федеральной службы по надзору в сфере
здравоохранения и социального
развития.
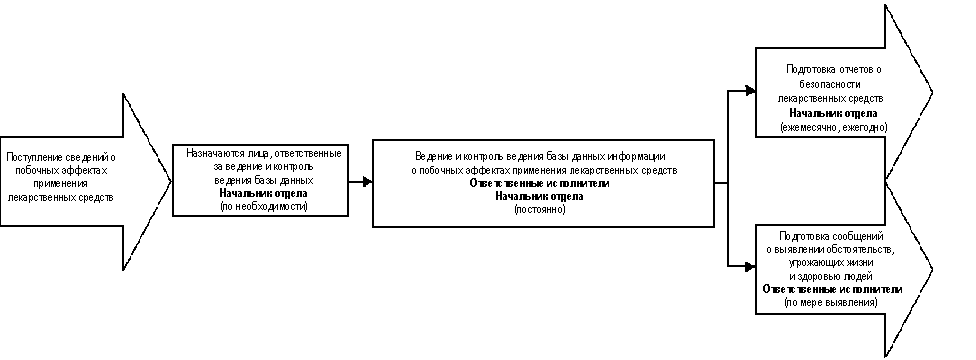
3.8. Административная
процедура "Осуществление сбора и анализа
информации о побочных эффектах
применения лекарственных средств"
осуществляется постоянно в соответствии
с нижеследующим порядком (схема
осуществления административной
процедуры приведена в приложении 7):
3.8.1. Лица, ответственные за
ведение базы данных и за контроль
ведения базы данных информации о
побочных эффектах применения
лекарственных средств, по мере
необходимости назначаются начальником
отдела, осуществляющего регистрацию
лекарственных средств, из числа
сотрудников отдела.
3.8.2. Источниками
документированных сведений о побочных
эффектах применения лекарственных
средств при осуществлении сбора и
анализа информации являются:
- собственные сведения Федеральной
службы по надзору в сфере
здравоохранения и социального развития
о случаях побочных действий
лекарственных средств и об особенностях
взаимодействия лекарственных средств с
другими средствами, которые не
соответствуют сведениям, содержащимся в
инструкциях по их применению;
- информация о побочных действиях
лекарственных средств, полученная в ходе
работы с обращениями частных лиц,
предпринимательских, государственных и
общественных организаций.
Сбор, обработка, анализ поступающих
сведений, внесение изменений в базу
данных информации о побочных эффектах
применения лекарственных средств и
контроль ведения базы данных должны
осуществляться соответствующими
ответственными лицами постоянно.
3.8.3. На основании полученных
сведений о побочных эффектах применения
лекарственных средств начальник отдела,
отвечающего за регистрацию
лекарственных средств, организует
подготовку:
- ежемесячных отчетов о
безопасности лекарственных средств;
- ежегодных отчетов о безопасности
лекарственных средств.
3.8.4. По мере выявления в ходе
сбора и анализа информации о побочных
эффектах применения лекарственных
средств обстоятельств, угрожающих жизни
и здоровью людей, ответственные лица
обязаны немедленно сообщать об этом
руководству Федеральной службы по
надзору в сфере здравоохранения и
социального развития.
Приложение 1
к Административному регламенту
Схема: Структура и взаимосвязи
административных процедур, выполняемых
при организации проведения экспертизы
качества, эффективности и безопасности
лекарственных средств |
|
Приложение 2
к Административному регламенту
Схема исполнения
административной процедуры |
Управление регистрации лекарственных средств и медицинской техники
|
|
Приложение 3
к Административному регламенту
Схема
исполнения административной процедуры |
Управление организации государственного контроля в сфере обращения медицинской продукции и средств реабилитации инвалидов
|
|
Приложение 4
к Административному регламенту
Схема
исполнения административной процедуры |
Управление организации государственного контроля в сфере обращения медицинской продукции и средств реабилитации инвалидов
|
|
Приложение 5
к Административному регламенту
Схема
исполнения административной процедуры
|
Управление организации государственного контроля в сфере обращения медицинской продукции и средств реабилитации инвалидов
|
|
Приложение 6
к Административному регламенту
Схема
исполнения административной процедуры |
Управление организации государственного контроля в сфере обращения медицинской продукции и средств реабилитации инвалидов
|
|
Приложение 7
к Административному регламенту
по исполнению государственной функции
по организации проведения
экспертизы качества, эффективности и
безопасности лекарственных средств
Схема
исполнения административной процедуры |
|
Управление регистрации лекарственных средств и медицинской техники
| |
| |
Электронный текст документа
подготовлен ЗАО "Кодекс" и сверен по:
Бюллетень нормативных актов
федеральных органов
исполнительной власти,
N 51, 18.12.2006
Ссылается на
- Об утверждении Положения о Министерстве здравоохранения и социального развития Российской Федерации (с изменениями на 2 мая 2012 года) (редакция, действующая с 1 июля 2012 года) (утратило силу с 10.07.2012)
- Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения (с изменениями на 24 октября 2025 года)
- О порядке разработки и утверждения административных регламентов исполнения государственных функций (предоставления государственных услуг) (с изменениями на 13 июня 2018 года)